使用电子标签的时代已经到来
新欧盟临床试验法规下可能的贴标解决方案
分类|临床试验服务
新欧盟临床试验法规 (CTR) 旨在简化临床试验管理,为欧洲的制药公司创造更舒适的经营环境。该法规统一了监管、贴标和质量授权人 (QP) 要求,具有法律约束力,申办者需要充分了解其要求。请继续阅读,了解该法规对制药行业的影响(包括合规途径),这需要经验丰富的人员、适应能力,还可能需要具有临床试验专业知识、全球布局、成熟技术和风险缓解技能的合作伙伴。
尽管制定过程中争论激烈,欧盟临床试验法规不允许临床试验用药物采用电子标签 (eLabel)。相反,临床试验用药的直接包装和二级包装上必须根据传统的小册子标签印刷有效期。
欧盟临床试验法规的贴标要求侧重于“使用期”的标示——临床试验用药品 (IMP) 或辅助药品 (AMP) 的有效期。临床试验用药品或辅助药品的直接包装或一级包装和二级包装上必须标示有效期。1

针对这些新要求,药企表达了多个方面的担忧:
- 重新加工成本——包括生产更多标签的成本以及相关的项目管理和机舱费用。对于有多个主容器的套件来说,这些成本更高。
- 篡改行为的出现——这是一个令人担忧的问题,因为为了符合要求,往往需要破坏二级包装的防篡改封条。
- 工厂能力——由于贴标活动必须在受控的 cGMP 环境中进行,一些工厂可能无法印刷、检查标签,甚至无法贴上标签。
- 低温产品贴标——必须保持低温的药品给重新贴标增加困难。
- 浪费——由于难以在一级包装上贴标,损坏和丢弃产品的风险增加。
欧盟临床试验法规 536/2014 中的标签规定:
有哪些变化?
欧盟临床试验法规 536/2014 附件 VI 要求,现在必须在直接包装上显示向临床试验供应的临床试验用药品或辅助药品的有效期或使用期,没有例外。2 这个要求大大影响了保存期延长能力,并阻止了可能的电子系统使用。
- 根据国家和/或地区对单独的药品进行贴标
- 使用准时生产法来避免到期问题
- 采用独特的包装设计,将主标签从纸箱中取出
- 只使用一级包装
- 在工厂和/或仓库重新贴标
- 提升风险数据/软件包的稳定性
- 实施电子标签解决方案
最后列出的电子标签可以有多种形式,其中几种可以通过云端快速更新。例如使用条形码、二维 (QR) 码、射频识别 (RFID) 标签以及粘贴在包装上且可更换的电子纸(图 1)。
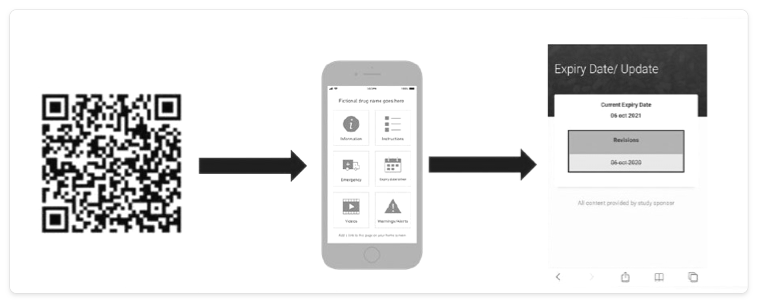
电子标签的基本功能和优势如下所示。
 Figure 2. Electronic labeling: functionality and benefits
Figure 2. Electronic labeling: functionality and benefits
根据一个在全球生物制药研发界就共同关心的话题开展合作的组织——TransCelerate的发现,对患者、工厂、监管机构和申办者而言,电子标签还具有下列优势:3
- 患者:
- 提高临床开发效率,让患者更快获得药物
- 进一步确保患者安全
- 提高临床试验标签的实用性和改善合规性的可能性,包括提供给药视频、加强沟通和改善易用性
- 工厂:
- 支持快速获取实时信息
- 确保提高贴标方法的效率
- 为今后与患者就其用药进行交流打下基础
- 监管机构:
- 减少重新粘贴过程中出现偏差的可能性(如与无菌度、防篡改封条、产品混淆或脱离环境时间有关的偏差)
- 为患者提供最新信息
- 衔接更多数字和创新策略
- 申办者:
- 提高标签创建的操作效率
- 增加混合策略,减少浪费
- 减少研究变化的反应时间
- 增加增值方案,包括依从性计划、患者分析和患者教育
在电子标签的早期推广中,由七大制药公司组成的处方信息现代化联盟发出了 2020 年倡议,4 该联盟称纸质标签已经过时,与患者安全信息的技术流程不相容。还有人指出,已批准标签的修改(平均每年需要进行五次)很耗时,而且可能存在延时,给患者带来安全风险。5 这些论点是有根据的,也许终于到了为临床试验用药物采用电子标签的时候了。一种可行方法是在使用必需的小册子标签的同时,开始小规模运用电子解决方案,其中包括以所有药物上市国语言提供的患者信息。如果能持续甚至更好地保护患者安全,该解决方案也许会提供监管机构之间信任建立所需的概念证明。
然而,在考虑新方案时,必须始终将患者安全放在首位。
外部合作伙伴能够帮助满足申办者对贴标合规性支持的需求,无论是有针对性地为大型制药公司提供能力补充,还是为新兴生物技术公司提供全方位的端到端包装和临床试验服务。希望在贴标进展方面进行合作的申办者应评估潜在合作伙伴的几种品质:
- 杰出的人员——这些人应拥有深厚的贴标经验,确保成功提供贴标方案,满足监管机构对有效期的要求。
- 适应能力——在传统方法的基础上,外部合作伙伴应能够迅速转向,在需要时采用和整合新方法。
- 临床试验专业知识——有经验的合作伙伴能与监管机构建立密切的合作关系,确保申办者满足合规要求。
- 庞大的网络——包括全球布局,提供国际联系和专业知识,并有能力协调和集中贴标涉及的许多接触点。
- 成熟的技术——外部合作伙伴应能提供已在全球工厂和仓库审查且经过验证可供患者使用的方法。
- 风险缓解和一流的质量控制——这将解决有关患者获取信息的一切顾虑,防止电子标签元素在整个供应链中受损,并最大限度地减少对环境有害的废物。
一旦满足最新标签要求的障碍被克服,申办者有望从新欧盟临床试验法规中受益,包括改进成员国之间和成员国内部的合作、信息共享和决策。

