mRNA 开发和 cGMP 生产服务
创新灵活的端到端解决方案可集成 mRNA 工作流程
mRNA 疫苗在新冠疫情期间的快速研发和获批,再次燃起了人们对 mRNA 技术的兴趣,同时也在关键原材料的获取和产能方面形成了市场制约。赛默飞迅速响应,推出了灵活的 mRNA 疫苗和药物应用解决方案模式,涵盖从 DNA 模板制备到冷链物流的整条运营价值链。赛默飞端到端解决方案通过可提供从早期临床试验到商业化生产的全程支持,从而节省时间和成本。所有的工作流程均可在我们位于意大利蒙扎的卓越中心完成。
传承创新和技术专长
我们拥有 30 多年的无菌灌装、生物制剂和前沿治疗药物生产经验,在助力分子药物从概念走向商业化方面成绩斐然。我们位于蒙扎的卓越中心专注于无菌灌装和 mRNA 服务,始终保持着出色的监管合规性,自 2004 年以来,顺利通过 13 家不同卫生监管机构开展的大约 80 次监管检查。凭借技术专长、生产经验以及完善的全球质量体系,我们推出了最新的 mRNA 服务;同时结合持续的内部创新,助力您优化药物性能、加快新药上市进程。
根据您独特的 mRNA 疫苗或治疗需求,提供灵活的工艺放大解决方案
从全球疫苗到个性化癌症治疗,mRNA 正被考虑用于多种临床应用,这对生产规模和质量提出了多样化的要求。为了应对这种不断变化的需求,我们提供在工艺放大和质量方面均具备灵活性的方案,以支持规模从低于 1 g 至 100 g 的 mRNA 和其他 RNA(如自我扩增型、环状等)治疗药物开发项目。此外,我们可以整合您现有的 mRNA 工艺流程,或协助您利用我们在蒙扎工厂开发的内部工艺流程。
包含集成 mRNA CDMO 服务的定制化方案
我们将灵活的开发和生产方法与全面的分析方法以及监管合规支持等关键基础能力相结合,为您提供专业的技术支持,帮助您在如今快速发展的 mRNA 市场中迅速实现成功。从工艺开发到 cGMP 生产,我们不仅为您提供核心 mRNA 服务方案,还可以根据您的需求提供上下游解决方案。我们还提供内部研发的资产,这些资产可无缝融入您的工作流程之中,可以帮您节省时间和成本。这些资产包括免许可、定制化pTRXi 质粒 DNA 骨架,可为不同大小的多种目的基因 (GOI) 提供支持。与赛默飞合作时,您可以选择利用我们完整的集成服务与解决方案,也可以选择那些有助于弥补您在能力或产能方面缺口的服务。

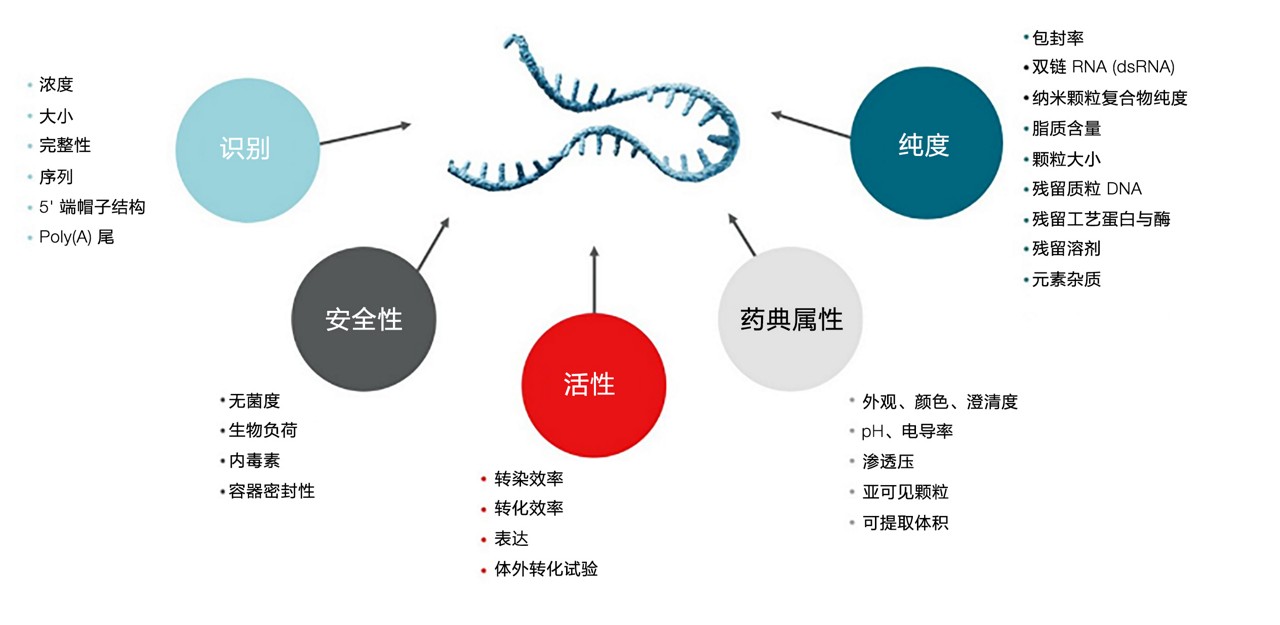
我们的团队采用系统化方法,确保满足临床应用与商业化生产条件,侧重于工艺与分析方法的优化,随后开展全面的确证与确认工作。该策略有助于降低风险,最终实现节省时间、减少成本的目标。我们 mRNA 工艺与分析方法开发服务的核心内容如下:
- 工艺表征研究
- 工艺放大与优化(规模从 μL 到 L)
- mRNA 合成工作流程的确定与优化
- 脂质制剂开发及溶剂去除工艺开发
- 灌装服务,例如处方和冻干工艺参数开发、工艺表征研究
- 开发并确认分析方法,以确保 RNA 和 LNP 产品的质量和有效性,在此工作流程中采用行业领先的技术,如二代测序 (NGS)、高效液相色谱 (HPLC) 等。
mRNA-脂质纳米颗粒 (LNP) 工艺开发 |
兼容性研究 |
熟悉度研究 |
原材料评估
|
稳健性研究 |
差距评估 |
mRNA-LNP 纯化 |
技术转移 |
mRNA-LNP 稳定性研究 |
后续流程 |
- 三种 RNA 合成和纯化工艺流程;单批次 mRNA 产量多达 100 g 以上
- 两个脂质纳米颗粒生产区域;工作容积为 500 L
- 多达 5 个用于合成与纯化的模块化生产单元
- 多达 4 个模块化脂质纳米颗粒生产区域
- 可支持从早期临床到商业化阶段(规模从低于 1 g 至 100 g)
- 年最大产能为 15 kg
- 各生产单元配备专用暖通空调 (HVAC) 及公用设施,以防交叉污染
- 生产区域环境维持 ISO 7 级/C 级洁净度

查看信息图 ,大概了解mRNA 标准生产工作流程 ,以及赛默飞如何为开发阶段的每一步提供专业的见解。
我们的团队可利用微流体技术或 T 型混合技术,提供各类脂质纳米颗粒 (LNP) 生产解决方案,同时涵盖全面的工艺与分析方法开发工具。为了给客户提供灵活的解决方案,我们会采用各类脂质技术。这包括可使用赛默飞全球网络工厂所研发的专有脂质,或采用基于实验设计 (DoE) 的系统方法,优化客户现有的脂质策略。
我们还具备丰富的经验和能力,可以高效处理技术转移项目。无论采用何种方式,我们都会与客户紧密合作,为其开发定制化的解决方案,确保其 LNP 工作流程可以无缝整合到我们的工厂中,同时发现各种可能存在的不足之处,并根据需求提出工艺优化建议。
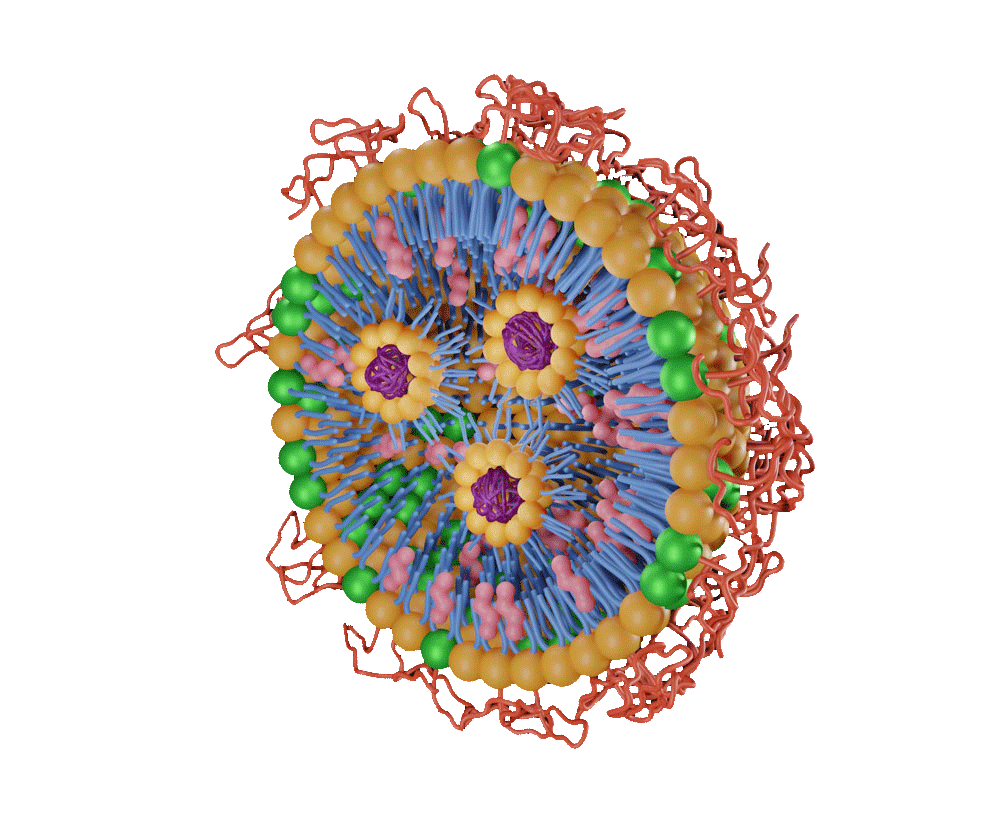
我们位于意大利蒙扎的工厂占地面积为 64.2 万平方英尺,是预灌封注射器与针筒生产以及 mRNA 原液 (DS) 制备的卓越中心。这种将 mRNA 生产能力与脂质纳米颗粒 (LNP) 相关服务以及灌装服务集中整合的独特模式,有助于简化您的药物开发流程,并降低新药上市过程中的风险。