病毒载体开发和生产服务
超过20年的丰富的病毒载体生产经验
病毒载体生产所采用的复杂工艺会在整个产品生命周期中遇到各种各样的挑战。主要问题围绕着选择生产系统、提高产品质量以及通过标准化实施稳健的 CMC 方法。
赛默飞病毒载体服务 (VVS) 能够提供病毒载体和基因疗法疫苗的开发和商业化CDMO服务。赛默飞病毒载体端到端能力包括工艺开发和分析方法开发、临床和商业化生产以及灌装服务。凭借庞大的工厂网络、全球临床供应链能力以及深厚的病毒载体技术知识和监管合规知识,我们能够帮助您减少风险,加快新药上市进程。
20+ 年的病毒载体经验
开发与生产
2 款产品获批上市
其他几款产品正在审批中
700+ 生产批次
已在北美和欧洲生产了 700 多个病毒载体 GMP 临床和商业化/工艺性能确认 (PPQ) 批次
50+ 原液生产区域
以及12个制剂生产区域
丰富的知识与经验助您从早期发现到商业生产的设计路径
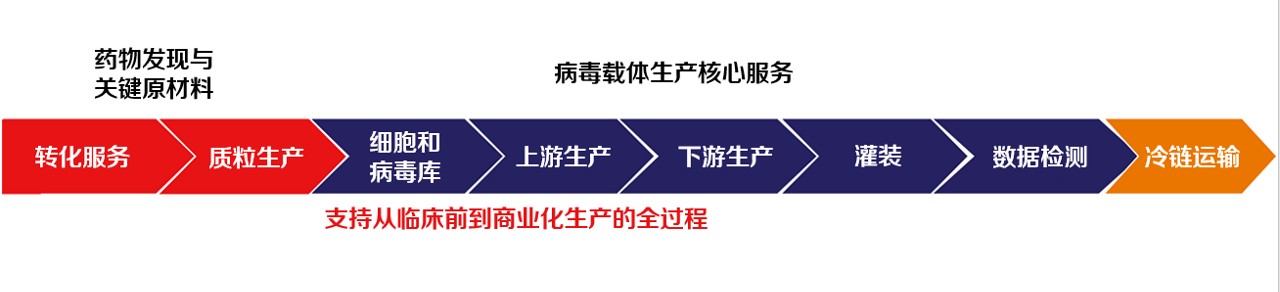
除了核心病毒载体生产服务外,我们还提供上游和下游产品,以支持您药品开发和生产过程的各个方面。从帮助优化小规模工艺的早期转化服务到促进最终产品安全储存和分发的冷链物流,我们为管理独特的基因疗法和基因修饰细胞疗法项目提供端到端解决方案。
病毒载体类型和平台
基于在 cGMP 病毒载体工艺开发方面的专长与知识,我们可根据产品、适应症和给药模式定制悬浮和贴壁工艺。我们在工艺开发、工艺优化、工艺放大、技术转移以及各种规模的 GMP 生产方面拥有丰富的经验。我们已成功生产了 700 多个 cGMP 批次的先进疗法药品,例如基因疗法药品、细胞疗法药品、疫苗、溶瘤病毒、非病毒载体和免疫疗法药品。
载体生产平台和工艺
| 腺病毒 | 腺相关病毒 (AAV) | |||||
|---|---|---|---|---|---|---|
| 贴壁和悬浮 | 生产用细胞株和腺病毒 | 贴壁和悬浮 | 贴壁和悬浮 | |||
| 哺乳动物细胞感染 | 哺乳动物细胞感染 | 哺乳动物细胞瞬时转染 | 昆虫细胞 – 感染 |
| 慢病毒 (LV) | 反转录病毒 (RV) | 单纯疱疹病毒 (HSV) | |||
|---|---|---|---|---|---|
| 贴壁和悬浮 | 贴壁和悬浮 | 贴壁和悬浮 | |||
| 哺乳动物细胞瞬时转染 | 哺乳动物细胞瞬时转染 | 哺乳动物细胞感染 |
| 改良型痘苗病毒安卡拉株 (MVA) | 水疱性口炎病毒 (VSV) | ||
|---|---|---|---|
| 悬浮 | 贴壁 | ||
| 感染和禽细胞株 | 感染和哺乳动物细胞瞬时转染 |
| 病毒样颗粒 (VLP) | |
|---|---|
| 悬浮 | |
| 昆虫细胞和哺乳动物细胞感染 |
赛默飞团队在支持其他各种病毒平台方面具有丰富的经验。 若对赛默飞的其他能力有任何疑问,欢迎 联系我们。
从发现到商业化的病毒载体 CDMO 能力
从工艺开发和工艺表征到生产、质量控制 (QC) 和灌装,VVS 具备多种必需的能力与知识,能够帮助您开发和生产病毒载体产品。
我们具有 20 多年的病毒载体产品开发经验,制定了上下游工艺开发和优化策略、工艺放大策略以及中试批次标准。在整个产品生命周期中,我们将指导您达成每个里程碑,并把控关键检查点,确保您符合所有质量标准。
- 上游处理——悬浮和贴壁形式、哺乳动物细胞培养和昆虫细胞培养、实验设计、工艺放大
- 下游处理——基于层析技术的纯化、用于提高产量/回收率的工艺优化、完整衣壳分离、特定纯度要求的满足
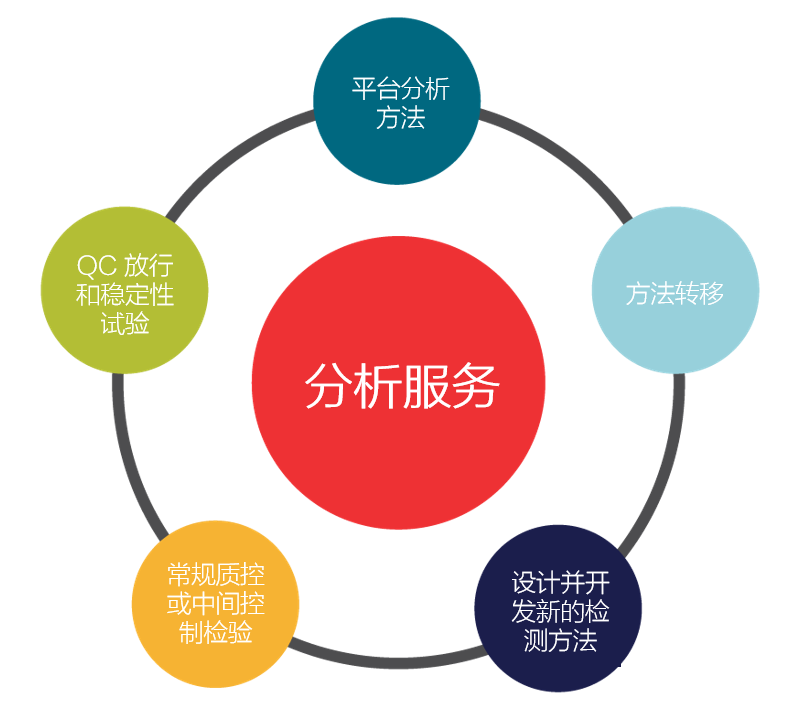
- 分析方法开发和分析测试方法创建、定制和开发、平台测试方法、工艺开发测试支持、临床前材料测试
赛默飞专门的病毒载体工厂可为全球临床和商业化应用生产符合 cGMP 标准的病毒载体,50 个原液生产区可支持各种生产模式和技术(细胞工厂、iCELLis、一次性生物反应器 (SUB) 等)。我们使用半自动和全自动灌装线以及一系列经过预先确认的西林瓶和容器密封系统,提供无菌灌装服务。除此之外,我们还能利用全球技术转移策略促进客户技术或内部开发和中试实验室的技术成功向赛默飞工厂转移并在赛默飞工厂中建立工艺。赛默飞的每家工厂都具备质量控制 (QC) 能力,可使用经过批准或验证的方法进行中间控制检验、放行测试和稳定性试验。
|
|
|
|
|
| 工艺缩小模型确认 | 生产支持研究 | 悬浮和贴壁形式 | 药典检测方法确证、检测方法确认和验证 | 处方评估 |
| 实验设计 (DoE) | 工艺验证计划和策略 | 临床和商业化规模产能 | 原液和制剂中间控制检验和批次放行检测 | 半自动和自动灌装线 (Bausch + Strobel, Optima) |
| 关键物料过期/批次差异研究 | 失效模式与影响分析 (FMEA) | 多种多样的技术及设备 | cGMP 稳定性研究 | 预确认的西林瓶配置 |
| 混合研究 | 验证支持研究 | 细胞库和病毒库建库 | 对照品确认 | 一级西林瓶贴标和包装 |
| 关键质量属性 (CQA) 分析 | 技术转移 | 工艺性能确认 (PPQ) | 测试桥接和产品可比性研究 | 每批次灌装量可达 10,000 个西林瓶 |
| 风险评估 | 技术转移和/或工艺放大的工程批次 | |||
| 关键工艺参数 (CPP)、重要工艺参数 (KPP) | 高达 2,000L 的生产批次 | |||
| 控制策略 |
先进疗法药品的监管环境在不断变化,今天满足要求的可能明天就不满足要求了。15 年来,我们一直在全球监管机构互动(美国、欧盟和加拿大)、CMC 法规、指南和检查方面为客户提供支持。除了提供文件审核和差距分析,赛默飞监管合规服务团队还能编制文件,从而减少中间环节的数量并缩短注册申报资料的准备时间。
- CMC 申报资料撰写
- 差距分析 和 CMC 申报资料审核
- CMC 监管合规策略咨询
- 卫生部门会议、申报和检查支持
- 熟知不断变化的监管指南
了解我们如何帮助您满足监管机构对细胞和基因疗法药品的要求: 下载资料页。
降低药品开发风险,加快进入临床试验阶段
Patheon Quick to Clinic™️ 病毒载体服务
您已经研究了各项方案,并权衡了不同表达系统的利弊。如果您想加快新药上市速度并简化上市过程,Patheon 的 Quick to Clinic™ 病毒载体服务是一项高性能、可扩展、端到端的腺相关病毒 (AAV) 载体和慢病毒 (LV) 载体生产计划。通过该计划,您能够减少项目进度和全球注册申报方面的风险,推动基因疗法药品进入临床试验阶段,并避免产生额外或意外开支。
了解更多
在短短六个月后开始毒理学研究
毒理学研究直达病毒载体服务
为了满足 IND 前法规要求,评估候选药品的风险获益比,毒理学研究很重要。然而,高质量毒理学研究物料的获取往往需要较长时间,而且如果毒理学研究物料生成流程与现行药品生产质量管理规范不符,也会阻碍项目进程。赛默飞毒理学研究直达病毒载体服务计划利用腺相关病毒 (AAV) 和慢病毒 (LV) 生产工艺加快毒理学研究物料的获取,可在短短六个月内完成。
了解更多
赛默飞病毒载体工厂
赛默飞病毒载体工厂在全球占地面积超过 555,000 平方英尺,可随时开发和生产病毒载体产品。我们能够用合适的产能、人才和技术生产出可靠的产品,同时确保多家工厂实施高质量且快速的生产工艺。我们整合了 Brammer Bio 和 Henogen 的病毒载体知识和经验以及 Fisher Clinical Services 的临床试验能力。
剑桥工厂占地面积 140,000 平方英尺,能够进行工艺验证、工艺表征、后期临床和商业化生产。该厂自 2018 年起开始生产病毒载体,并于 2021 年首季度获得首张商用许可证。
相关资源

Blog
Viral vector commercialization – Part 1: Tech transfer process for commercial viral vector manufacturing
Learn how tech transfers can help develop and manufacture viral vectors at scale, accelerate vaccine and gene therapy commercialization, and provide expertise.

Blog
Viral vector commercialization – Part 2: Best practices in process validation lifecycle
Learn more about the robust viral vector process validation cycle, which includes various assessments and studies to ensure the safety, efficacy, and quality of viral vectors.

Article
Strategies to accelerate drug development through harmonization of early and late stage processes
This technical article presents a harmonized and streamlined approach established at Thermo Fisher Scientific for manufacturing AAV and LV vectors for discovery research using technologies and processes mirroring current GMP platforms.
View Article
Webinar
Preparing viral vector productions for commercialization
Gene therapy vectors are rapidly approaching the commercial space so commercial readiness is critical for success. Watch our webinar to learn about our capabilities and approaches for preparing viral vectors for commercialization.
View Webinar
Inforgraphic
Regulatory pathways for CGT and ATMP products
CGT is one of the world's fastest-growing therapeutic areas today. Instead of treating patients for the rest of their lives, these therapies offer them hope of a cure. In this infographic, we will review three tips for achieving regulatory success.
View Infographic
eBook
Cell and gene therapies in the US vs. the EU: Top five areas of differentiation
In this eBook we share the five key differences in the drug development and review process for companies hoping to gain market access through US Food and Drug Administration (FDA) or European Medicines Agency (EMA) approval—as well as tips for navigating these differences.

资料页
病毒载体开发和生产服务
20 多年来,赛默飞在病毒载体产品的开发和生产方面积累了丰富的经验。我们专门解决用于细胞和基因疗法药品的病毒载体生产中的难题,包括选择生产系统、提高产品质量以及通过标准化实施稳健的 CMC 方法。



文章
通过协调早期和后期工艺加快药物开发的策略
本篇技术文章介绍了赛默飞如何利用与当前 GMP 平台相匹配的技术和工艺制定协调精简的腺相关病毒 (AAV) 载体和慢病毒 (LV) 载体生产方法,推动新药发现研究。
阅读文章

信息图
细胞和基因治疗药物和先进治疗药物的监管合规途径
细胞和基因疗法(CGT) 发展迅速,该疗法不是让患者终生接受治疗,而是为他们带来治愈的希望。本信息图描述了顺利通过监管机构审批的三大要诀。
查看信息图
电子书
美国与欧盟的细胞和基因疗法药品:五大差异
该电子书介绍了关于药品开发以及美国食品药品监督管理局 (FDA) 和欧洲药品管理局 (EMA) 药品上市审核流程的五大差异,并就如何应对这些差异给出了建议。
阅读文章