cGMP 细胞疗法药品开发和生产服务
技术知识与灵活执行相结合,满足您独特的项目需求
虽然细胞疗法药品为患者提供了振奋人心的新疗法模式,但分析方法、可放大性、监管障碍等诸多复杂因素会阻碍细胞疗法药品成功实现商业化。赛默飞认识到,为了应对这些挑战,为细胞疗法药品项目采取个性化方法无比重要。作为一家综合型细胞疗法药品CDMO,我们能够进行工艺开发、分析方法开发和 cGMP 生产,为客户提供从临床试验阶段到商业化阶段的全程支持。
熟知各种分子样式
我们提供各种形式的支持系统和技术知识作为基础,包括:
- 自体和异体疗法药品
- 病毒修饰和非病毒修饰的基因传递系统
- T 细胞、自然杀伤细胞、诱导多能干细胞、间充质干细胞等
灵活且快速上市
作为赛默飞Patheon™ 制药服务所提供的服务之一,细胞疗法药品生产业务已拥有超过20年的经验,具备您持续快速发展所需的知识和灵活性。我们的生产准备方法兼顾速度、质量和创新。此外,我们位于美国加利福尼亚州旧金山的现代化工厂提供可由用户配置的生产区,在您迈向商业化的同时确保长期可扩展性。我们采用“即时”策略扩建生产设施,努力将您独特的空间概念快速转化为生产设施,从而赶上您的项目进度。
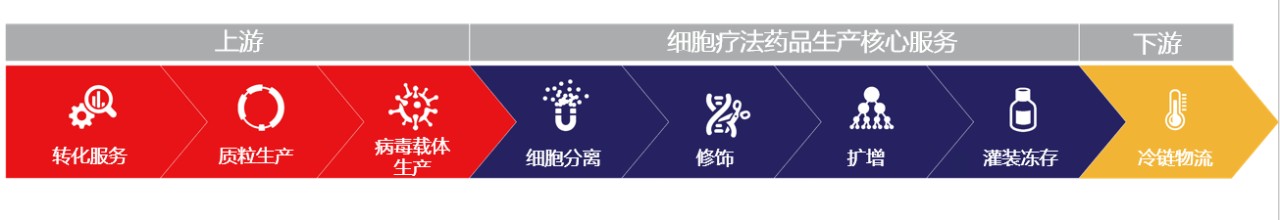
细胞疗法药品服务的整体解决方案
除了细胞疗法药品生产核心服务,我们还提供上下游服务来支持您的开发工作。从有助于优化小规模工艺的早期转化服务,到促进终端产品安全储存和分发的冷链物流,我们提供一站式解决方案,满足您细胞疗法药品项目的独特需求。
- 条理清晰的工艺优化、确证和确认方法
- 工艺封闭化和自动化方面的丰富知识
- 生产工作流程向 cGMP 生产区的转移

- 起始物料、中间控制和产品监测和取样
- 符合行业标准的检验
- 用于准确表征产品的检验开发、验证和确认

先进疗法药品的监管要求在不断变化,今天满足要求的条件可能明天就需要更改了。15 年来,我们一直在全球监管机构互动(美国、欧盟和加拿大)、CMC 法规、指南和检查方面为客户提供支持。除了提供文件审核和差距分析,赛默飞监管合规服务团队还能编制文件,从而减少中间环节的数量并缩短注册申报资料的准备时间。
- CMC 资料撰写
- 差距分析与 CMC 申报资料审核
- CMC 监管合规策略咨询
- 卫生部门会议、申报和检查支持
- 熟知不断变化的监管指南
这座现代化工厂占地面积 44,000 平方英尺,毗邻旧金山湾区多家肿瘤医院,距旧金山国际机场约 15 分钟车程。工厂配备可由用户配置的个性化 cGMP 生产区,每个生产区都安装了独特、专用的暖通空调系统,因此可同时支持多个细胞株/多款产品的生产。
相关资源

资料页
细胞与基因疗法解决方案
细胞和基因疗法市场发展快速,其处于加速的市场批准机会、创纪录的投资、强大的治疗管线和积极的临床结果的良好环境中——这些都推动了对速度、监管知识和生产技术创新的需求。
查看资料页
在线讲座
与综合型 CRO/CDMO 合作,加快向患者提供细胞疗法药物
欢迎观看线上讲座,深入了解为何与综合型 CRO/CDMO 合作有助于克服行业挑战、加速从开发到生产的整个过程,以及统一的团队和基础设施具有哪些优势。
观看在线讲座
视频
自体和异体疗法 - 现状和未来:了解科学、生产和监管方面的考虑因素
在此次圆桌会议中,临床和商业化专家论述了异体和自体细胞治疗药物的复杂性,并对行业的现状和未来提出了见解。具体议题包括生产和物流的良好实践、监管环境和 CMC 要求以及标准化的作用。
观看视频

电子书
美国与欧盟的细胞和基因疗法:五大差异
本电子书分享了希望通过美国食品和药物管理局 (FDA) 或欧洲药品管理局 (EMA) 批准获得市场准入的公司在药物开发和审查过程中的五个关键差异,以及处理这些差异的技巧。
查看电子书
线上讲座
选择细胞疗法生产CDMO合作伙伴时的关键考虑因素
与许多治疗性生产工作流程一样,mRNA工艺的每一步都建立在前一步的基础上。此信息图探讨了 mRNA 生产过程中每个相互交织的步骤,并概述了赛默飞的灵活方法如何让您的 mRNA 产品更快地进入临床和市场。
观看在线讲座