无菌制剂灌装服务
高效完成注射药品的生产
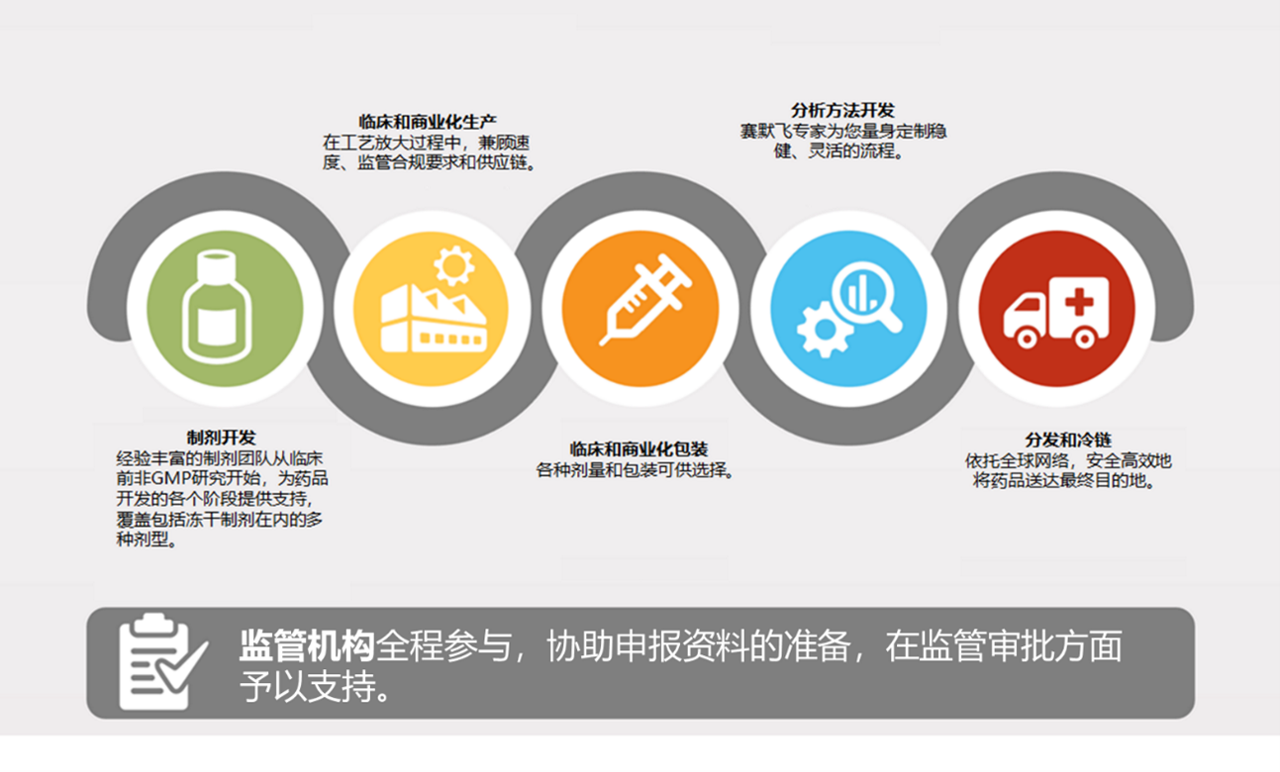
西林瓶、预灌封注射器和卡式瓶灌装服务
我们提供各种剂型的无菌注射剂,满足分子药品从临床前研究向首次人体试验 (FIH) 和其他阶段过渡时的特定需求。
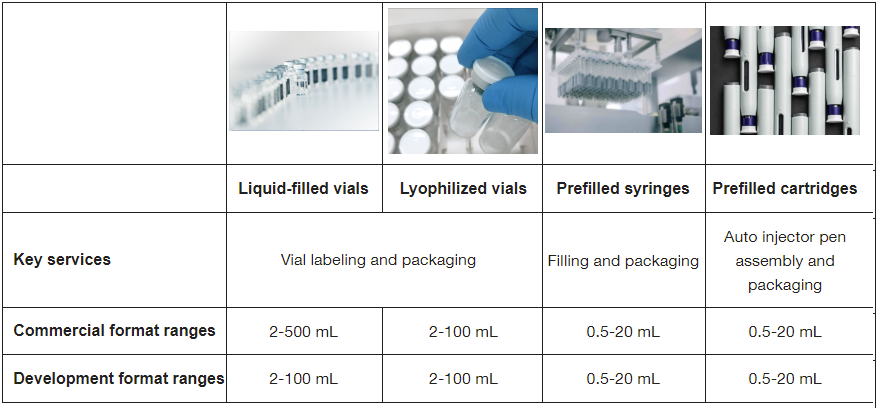
 |
 |
 |
 |
|
| 主要服务 | ||||
| 商业化规格 | ||||
| 临床开发规格 | ||||
我们的工厂遍布全球,有关具体的工厂信息,欢迎点击联系我们留言了解。
注射剂无菌灌装解决方案
与领先的注射剂 CDMO 合作,完成药品从处方开发到商业化的过渡。赛默飞团队能够根据产品生命周期各阶段的不同需求,运用数十年的经验帮助您生产各种剂型的注射剂。
在时间紧迫的时候,开发正确的处方可能非常耗时。药物的化学性质可能会带来重大挑战,例如对温度和剪切敏感、溶解度差以及活性高。如果需要冻干,则需要进行工艺优化。
我们拥有一套成熟的注射剂处方开发流程:
1. 处方前研究: 确定最佳的 pH 值、离子强度和降解途径并进行稳定性试验
2. 处方开发: 通过单次单因子法 (OFaT) 和/或实验设计法 (DoE) 选择并确定所有赋形剂的最佳浓度
3. 处方确认: 使用分析工具确认所选最终处方的稳定性
进一步了解赛默飞针对以下类型药物提供的处方开发服务:

降低临床前和临床 I 期研究的成本并确保质量
临床前和临床 I 期研究由于时间较长,所以成本高昂。确保早期开发流程的质量和一致性对于阶段转换至关重要。可行的方法包括采用冻干工艺以及使用非 cGMP 批次和预先确认的组分。冻干工艺能够提高稳定性,从而在临床试验期间延长药物有效期。
为了节省时间和资金,我们提供非 cGMP 生产区,确保设备可用于工艺放大。我们的非 cGMP 生产线具有与 cGMP 生产线类似的设置—采用的材料相同,但省去了 cGMP 空间所需的无菌操作和相关成本。
为了让您的产品在整个生命周期内取得长期成功,赛默飞专家可为您量身定制稳健、灵活的流程,包括:
- 冻干工艺开发和优化
- 生产工艺开发研究:
- 混合和泵切研究
- 保持时间研究
- 冻融研究
- 工艺可放大性研究
- 制剂接触部件相容性研究
- 已证实可接受范围 (PAR) 研究
- 人用药品注册技术要求国际协调理事会 (ICH) 稳定性试验
- 运输箱选择
- 组分相容性测试
- 清洁验证
- 使用中稳定性试验
- 灭菌工艺开发和验证

凭借 30 多年的临床试验经验,我们能够安全准时地将药物送达目的地。无论您的临床试验用药品 (IMP) 是传统的小分子药品、生物制剂还是先进治疗药品,我们都能为您提供策略、采购、管理、包装和贴标、储存以及分发服务。如需了解更多信息,欢迎访问临床试验服务页面。
冷链服务、物流和管理
确保您的产品完好无损地到达目的地并且可以直接使用。赛默飞全球网络支持工厂间全面互联,提供可靠的储存、包装、贴标和运输服务。
进一步了解赛默飞低温和超低温供应链管理和物流服务。

全球无菌制剂灌装工厂
意大利蒙扎工厂占地 642,000 平方英尺,是无菌生产的优质中心。它可以同时满足 mRNA 生产、LNP 和灌装需求,以帮助简化您的流程并降低风险。
我们位于北卡罗来纳州格林维尔的工厂是一个大型的多功能药品生产和包装工厂。该工厂提供固体剂型生产和包装,以及生物制药和小分子的无菌剂型生产、灌装和冻干。
我们的费伦蒂诺工厂占地 14,034 平方米(151,061 平方英尺),专门从事一体化无菌液体和冻干产品开发和商业生产,提供高效的产品和大容量肠外注射液(LVP)。
斯温顿工厂专门从事一体化无菌液体和冻干产品的开发和商业生产,包括高效产品和 LVP。工厂为无菌剂型提供广泛的开发和商业化能力,包括液体西林瓶、商业灌装生产线以及初级和次级西林瓶的包装。
新加坡工厂拥有优秀的无菌药品开发和生产设施,为不断扩大的生物制药市场提供快速灌装疫苗和其他疗法支持。


